Diez obstáculos que dificultan el acceso de los pacientes a nuevos medicamentos
Nabil Daoud | 1 de junio de 2021
De todas las modalidades deportivas, las carreras de obstáculos son las más emocionantes. Un atleta magnífico en el culmen de sus capacidades puede ir varios metros delante del resto... pero falla en la última valla y queda el último. Esperamos que los atrasados Juegos Olímpicos de Tokio se celebren a finales de este año y seguiré, con emoción y angustia, las hazañas del gran atleta español de 110 metros de vallas, Orlando Ortega. Sé que, por mucho trabajo y sacrificio que haya realizado durante años, cualquiera de esos diez obstáculos de tortura puede sacarlo y alejarlo del podio.
Asegurar el acceso de los pacientes a los medicamentos a menudo se siente como una carrera de obstáculos de 110 metros. Si bien su tramo final es mucho más largo de los aproximadamente 13 segundos que Ortega tiene a su disposición, los pacientes en Europa también afrontan 10 obstáculos importantes antes de poder acceder a nuevos medicamentos
y tratamientos.
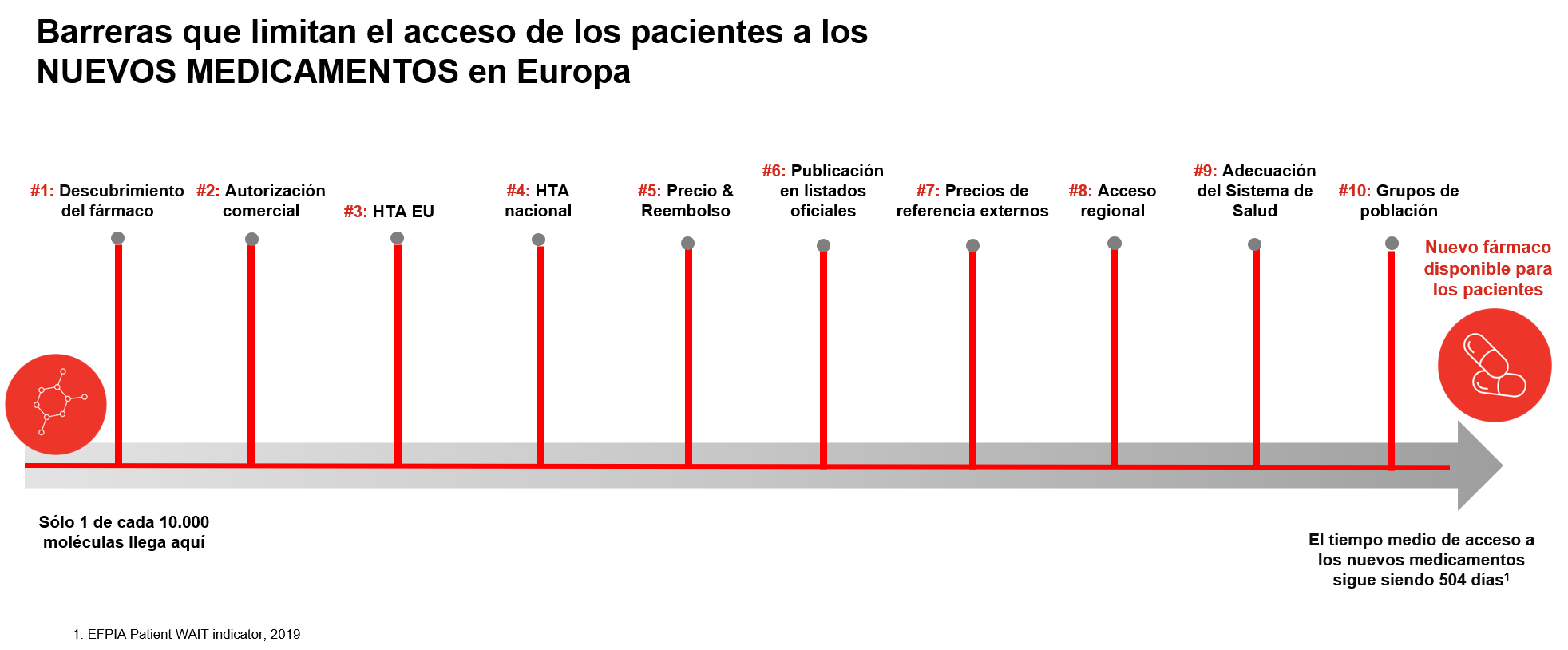
El primer obstáculo es la ciencia involucrada en el desarrollo de la medicina. Solo 1 de cada 10.000 de las moléculas probadas inicialmente en laboratorio se convierte finalmente en un medicamento. ¡Eso significa que solo el 0,01% realmente supera la línea de salida!
Pero solo estamos empezando. El segundo obstáculo es la autorización de comercialización central otorgada por la Agencia Europea de Medicamentos (EMA), en la que se evalúa la seguridad y la eficacia. Esto se puede demorar hasta 210 días, el plazo límite de autorización de la EMA, más los 67 días de media que necesita la Comisión Europea para otorgar formalmente la autorización de comercialización.
A continuación, llegamos a los obstáculos de fármaco-economía (conocido en inglés como Health Technology Assessment o HTA), donde se evalúa a los nuevos medicamentos y a las tecnologías sanitarias en función de su valor añadido en comparación con lo existente. El obstáculo número tres, la HTA de la UE, todavía está en construcción, y esperábamos que redujera el siguiente impedimento: las evaluaciones de fármaco-economía nacionales. Pero parece que la HTA de la UE puede convertirse simplemente en otro obstáculo adicional, que agrega complejidad y duplicación.
En el obstáculo número cuatro, la pista se ensancha, ya que la mayoría de los países tienen sus propias HTA, con una amplia variabilidad y complejidad.
El quinto obstáculo implica la fijación de precios y el reembolso a nivel nacional. En teoría, esto debería llevar un máximo de 180 días, pero la Comisión Europea rara vez aplica la regla de la Directiva de Transparencia, y observamos grandes discrepancias entre países: por ejemplo, van -de media- de los 120 días en Alemania a los 641 en Portugal y a los 815 días en Polonia.(1)
Algunos países, como Italia y España, tienen entonces un sexto obstáculo, ya que hay un retraso entre el momento en el que se acuerda el precio y el reembolso, y el momento en
que se formaliza mediante la publicación en un boletín oficial.
Otros países luego añaden un séptimo obstáculo. Como es el caso de Rumanía, donde los medicamentos solo se aprobarán si están disponibles en otros 12 países de la UE, e incluso
entonces, el reembolso debe establecerse a su precio más bajo. Este llamado precio de referencia externo ayuda a explicar el retraso medio de 883 días en Rumania para que los pacientes accedan a nuevos medicamentos.
¡La carrera aún no ha terminado! En varios países, entre los que aparecen de nuevo Italia y España, una vez que las autoridades nacionales acuerdan la fijación de precios y el reembolso, el proceso pasa a las autoridades regionales pertinentes. El tiempo derivado de este obstáculo varía enormemente según la región en cuestión.
Las decisiones de precios y reembolsos a nivel nacional y regional NO son el final del viaje. A continuación, tenemos la preparación del sistema de salud, que evalúa si se cuenta con los presupuestos adecuados y el registro, diagnóstico u otra infraestructura de atención médica de apoyo necesaria.
Por último, pero no menos importante, el último obstáculo es la población de pacientes. Por lo general, se considera que esto es bastante amplio en la etapa de autorización de comercialización de la EMA, pero en el momento en que se han enfrentado los obstáculos anteriores, la disponibilidad real de un medicamento o tratamiento puede ser muy limitada: solo sobre la base de un “paciente concreto” o sin disponibilidad en varias localidades.
Este salto de vallas frustra a todo el mundo, pero sobre todo a los pacientes que podrían
beneficiarse de un acceso más temprano a las innovaciones sanitarias. Pero arreglar el acceso es, por supuesto, un desafío inmenso. Hay tantos procesos duplicados, profundamente arraigados, que deben simplificarse. ¿Por dónde se empieza? Por un lado, evaluando cómo podemos aprender de la velocidad observada en nuestra reacción colectiva a la pandemia para que se mantenga incluso en días normales (por ejemplo, aprobación de la comisión más rápidamente, como han sido las 24 horas de aprobación de las vacunas frente a los 67 días que lleva habitualmente; y evaluación paralela con los organismos de evaluación de tecnología sanitaria -HTA). Y, en segundo lugar, trabajando juntos de manera más eficaz, en todos los países y todas las partes interesadas. El derecho de todos los ciudadanos europeos al acceso oportuno a una atención sanitaria asequible, preventiva y curativa de buena calidad es uno de los principios clave del pilar europeo de derechos sociales. Necesitamos soluciones prácticas y rápidas para asegurarnos que se respete.
Referencias:
EFPIA Patient WAIT indicator, 2020
